
date de mise en ligne : le 26 mai 2002
dernière mise à jour le 1er octobre 2009
Evaluation de la douleur chez le sujet âgé dément non verbalisant
Les auteurs :
Pradines V. Centre de Geriatrie, 170 Avenue de Casselardit, 31300 Toulouse.
Courriel : vpradines@hotmail.com
Pradines
B. Service des Soins de Longue Durée. Centre Hospitalier. 81013 Albi Cedex.
France. bpradines@aol.com. Site
Internet : http://www.geriatrie-albi.fr
Poli P. Service de Psychogériatrie, Fondation Le Bon Sauveur d'Alby, 81000 Albi.
Manteau R. Service des Soins de Longue Durée. Centre Hospitalier. 81013 Albi Cedex. France.
Résumé :
La douleur chez le sujet âgé dément pose
d’abord le problème de son dépistage dans un contexte toujours complexe : troubles
cognitifs englobant des altérations de la communication verbale, anxiété, dépression, incapacités fonctionnelles. L’évaluation proprement dite doit
englober cette comorbidité. Multidisciplinarité et persévérance sont les passages obligés d’une bonne prise en charge de la douleur.
Mots-clefs : personne âgée, douleur, démence, détection, évaluation.
L’évaluation de la douleur chez le sujet âgé dément est un défi
quotidien.
Cette situation est liée à :
- l’accroissement de l’espérance de vie,
- la prévalence élevée des démences dans la population vieillissante,
- l’absence de perspective thérapeutique curative nettement efficace dans le domaine des démences,
- l'importante prévalence des douleurs chez les personnes âgées,
- les difficultés accrues du dépistage, du diagnostic et du traitement des douleurs dans ce contexte.
Ces éléments bien connus ne doivent pas masquer l'hétérogénéité des situations rencontrées. Cette complexité naît de l’association de composantes diverses : les âges, les démences et les douleurs
survenant sur une personne unique. Aussi, cet exposé définira seulement des attitudes de principe.
Le dépistage de la douleur
Situation inhabituelle
par ailleurs : avant toute évaluation chez la personne âgée non verbalisante, il convient
d'abord de dépister l'existence d'une douleur. Ce problème est d’autant plus prégnant que la démence est évoluée. Puis l’évaluation proprement dite s’attachera à décrire la douleur et ses conséquences
(1). Enfin, l'appréciation de l’efficacité thérapeutique permettra de guider la poursuite
du traitement.
Figure 1
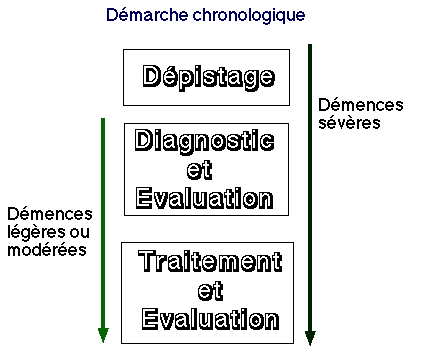
L'évaluation ne se conçoit que pour une douleur identifiée comme telle dans un contexte d'inconforts potentiels multiples. L'efficacité du dépistage suppose une culture de la douleur chez toutes les personnes qui entourent les déments âgés.
L'évaluation de la douleur
Les troubles sensoriels, mnésiques, gnosiques, thymiques et fonctionnels sont, peu ou prou, au rendez-vous du double défi de la démence et de l’âge. Ainsi, le patient souffrant d’une forme de démence présente tôt ou tard des troubles de la communication modifiant ou interdisant la plainte douloureuse verbale habituelle.
Une douleur peut se manifester spontanément ou,
plus souvent, n’apparaître que lors des mobilisations,
en particulier lors des soins de nursing. Toute suspicion doit être transmise systématiquement au prescripteur dans une démarche multidisciplinaire.
Quels sont les arguments en faveur de l’existence d’une douleur ?
La recherche des antécédents douloureux :
Cette quête est indispensable dans cette situation de troubles mnésiques constants. Elle est effectuée auprès de l’entourage habituel du patient
: soignants, famille, aidants. En l’absence de mesure thérapeutique décisive, une pathologie douloureuse ancienne a peu de chances de disparaître spontanément. Même si la démence est susceptible d’en modifier l'expression comportementale,
qu'elle soit
verbale ou non verbale.
Des renseignements précieux seront systématiquement recherchés :
- dans le dossier médical du patient,
- auprès des soignants. Les fiches de liaison sont généralement peu prolixes sur ce sujet, davantage soucieuses des mesures immédiates
nécessitées par la dépendance pour les actes de la vie quotidienne.
- surtout auprès des proches qui représentent souvent la meilleure source d’informations dans ce domaine.
Le classique envahissement du discours par la plainte douloureuse ne
pose pas de difficulté et conduit toujours à l’étape suivante : l'évaluation.
De façon moins évidente, la simple évocation par
le sujet âgé d’un terme appartenant au vocabulaire de la douleur doit
attirer l’attention.
L’interrogatoire, quand il est encore possible, est souvent fructueux, même dans cette condition (2,
3). Il est généralement contemporain d’une première approche clinique.
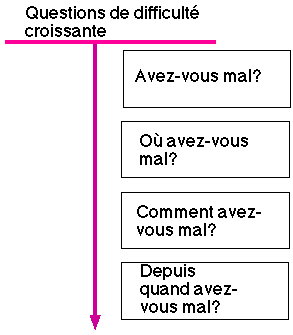
Les questions sont (4) :
- claires : elles utilisent un vocabulaire simple. L'emploi éventuel de la langue maternelle du patient
n'est pas oubliée.
- si possible destinées à une réponse par “oui” ou par “non”.
- courtes, utilisant des mots habituels : “avez-vous mal ?”, “où avez-vous mal
?”, “comment cela fait-il mal ?”
- positives : "avez-vous mal ?" plutôt que "n'avez-vous pas mal
?", ou bien "cela brûle-t-il ?” au lieu de "cela ne brûle-t-il pas
?".
- au présent de l’indicatif. A un stade avancé de la démence, la désorientation temporelle est souvent génératrice de confusion dans les conjugaisons des verbes : "j'ai mal
!" représente une généralité temporelle pouvant signifier : "j'ai eu mal
!". La précision par la question "et maintenant, en ce moment, avez-vous mal
?" est indispensable. Une douleur intermittente, modalité la plus fréquente en institution, est souvent "gommée" par les troubles mnésiques. Aussi, l’évaluation devra-t-elle être renouvelée.
- les conditions de l'entretien sont importantes
: le soignant se situe face au patient, il est assis à sa hauteur, son visage est éclairé, l’ambiance est silencieuse. Les interférences sont évitées, le temps ne doit pas être compté.
- les mots sont articulés lentement et distingués entre eux, "comme ceux
d'un prêtre dans une église".
- le patient est sollicité lentement afin de désigner les zones évoquées: "montrez-moi où vous avez mal !". Eventuellement : "Montrez-le sur moi !"
- les zones suspectes sont montrées par l'examinateur pour confirmation. L'interrogatoire est vérifié par l'examen clinique lorsque son résultat n’est pas explicite. Des gestes doux sont pratiqués sur les zones suspectes. Schuler (5) étudie des malades âgés souffrant de douleurs aiguës (N = 36) ou chroniques (N = 55). Les patients atteints de troubles cognitifs décrivent la localisation de leur douleur aiguë de manière moins précise que les patients dont l'évolution démentielle est moins avancée. Par contre, la mesure de l'intensité n'est pas affectée par l'état cognitif.
- la mimique est observée pendant l’examen clinique de dépistage chez
le malade non verbalisant : le regard de l’examinateur se pose alternativement sur les zones suspectes et sur le visage du patient
pour détecter le stimulus douloureux, mais aussi pour le limiter.
- l'examinateur est éventuellement relayé par un collègue : certains soignants ou certaines voix "passent" mieux que d'autres. Il existe parfois une disparité entre les soignants pour comprendre la parole résiduelle de ces patients fréquemment atteints de dysarthrie.
- anticipant sur l’évaluation proprement dite, l'intensité de la douleur peut être parfois évoquée en faisant un geste ascendant mimant une échelle virtuelle, à la fois visuelle et verbale : un peu, moyen, beaucoup
?
Ces mots simples doivent être ceux du langage commun, celui qui persiste le plus longtemps,
tant dans sa compréhension que dans son expression.
Figure 2 : questions habituelles lors de
la première approche, parfois réduites à un ou deux mots significatifs.
L’observation par l’équipe soignante ne peut se concevoir que dans un environnement sensibilisé à la détection des symptômes pénibles
: des manifestations vocales, un comportement douloureux non verbal, ou encore des changements fonctionnels récents. Sont particulièrement recherchés : les gémissements, les cris et les pleurs, les attitudes de retrait ou d’agitation, l’altération de la marche ou d’une autre fonction
habituellement correcte.
L'examen clinique du patient dément parvenu à l'absence de communication verbale est systématique et soigneux. La douleur est recherchée appareil par appareil, voire zone par zone.
Trois appareils méritent une mention particulière :
- l'appareil ostéo-articulaire : les articulations sont doucement mobilisées.
- l’appareil neuro-musculaire à la recherche d’atteintes neurologiques : anesthésie,
engourdissement, paresthésies, hyperalgésie, hyperpathie, allodynie, déficit moteur.
- la peau à la recherche de plaies de pression débutantes. Les escarres talonnières représentent une fréquente source de douleurs.
L'observation clinique minutieuse fournit souvent
la clef de l'énigme : citons simplement l’intérêt du diagnostic précoce d’un zona dans la prévention des douleurs séquellaires de cette affection. Autre
exemple : les névralgies faciales dont les épisodes fulgurants sont susceptibles d’être observées seulement par l’entourage chez un patient amnésique.
Enfin, un débat multidisciplinaire entre les divers intervenants est indispensable pour effectuer la synthèse des informations. Il s’agit d’un point crucial de la prise en charge de la douleur. Les cris de douleur sont intuitivement détectés comme tels grâce à la connaissance des manifestations habituelles(6). Beaucoup de difficultés à débattre : les mêmes émotions, les mêmes sensations, ne seront pas transmises à l’identique au conjoint, au médecin ou à l’aide soignante. Une localisation douloureuse peut en cacher une autre. Une
douleur peut être projetée ou rapportée. Elle peut présenter des caractères fluctuants dans le temps et suivant les situations. La suspicion d’un type particulier de douleur repose dans ce contexte sur une observation permanente
de proximité.
Pour parler de manière triviale, il ne suffit pas de regarder la photographie,
il faut aussi voir le film.
L'évaluation proprement dite
L’évaluation de la démence
Cet aspect sera volontiers sibyllin dans cet exposé. La sévérité de la démence est
couramment appréciée par des outils tels que le MMSE (Mini Mental Status Examination)
de Folstein (7) dans le contexte des critères définis par le DSM IV ou conjointement
par le NINCDS et l'ADRDA. Cette évaluation renseigne indirectement sur la composante
cognitive de la douleur.
Le retentissement de la pathologie démentielle sur les activités de la vie quotidienne est évalué par des échelles telles que l’IADL (Instrumental Activity of Daily Living) pour les démences modérées et l’ADL (Activity of Daily Living) pour les formes plus sévères. En France, la grille AGGIR (Action Gérontologique Groupes Iso Ressources) remplace souvent cette dernière grille. Il conviendra de s'approcher ainsi du retentissement fonctionnel de la démence afin de le distinguer de celui qui est lié à la douleur.
L’évaluation de la douleur
Quels sont les éléments d'appréciation à notre disposition
?
Les caractéristiques des antécédents douloureux sont recherchées : intensité de la douleur, fréquence, localisation, durée, circonstances aggravantes et facteurs ayant apporté un soulagement.
Les tentatives thérapeutiques antérieures, médicamenteuses ou non, sont répertoriées. La connaissance de leur efficacité et de leurs effets secondaires est un guide précieux pour la conduite à tenir.
Les caractéristiques de la plainte douloureuse constituent des indices à la fois quantitatifs et qualitatifs. Leur valeur se fonde sur la connaissance des plaintes habituelles du patient. En urgence, toutefois, l’appréciation ne peut pas être subtile.
Les outils d'évaluation :
- Les échelles dites "multidimensionnelles" :
Le questionnaire français de type Mac Gill (8) est le QDSA (Questionnaire de la Douleur Saint-Antoine. Il n'est jamais utilisable dans ce contexte.
- Les échelles dites "unidimensionnelles"
:
* l'échelle visuelle analogique (EVA) se présente sous la forme d'une réglette munie d'un curseur. Le patient est invité à déplacer ce curseur du bas de la ligne "pas de douleur" vers le haut "douleur insupportable" ou “douleur maximale imaginable”. Au dos de la réglette figure une échelle numérique graduée de 0 à 100 millimètres, permettant au soignant d'effectuer
une cotation chiffrée. Cette évaluation est le plus souvent rendue impossible par les troubles cognitifs
(9). A la rigueur, l’EVA peut parfois être utilisée comme un outil d'hétéro-évaluation dans ce contexte.
* les échelles numériques (EN): elles sont
graduées de 0 à 10 ou de 0 à 100. Le principe est le même que celui de l’EVA : le patient effectue ici
une cotation directe de l'intensité douloureuse. Une échelle numérique mérite d’être proposée si la démence n’est pas trop évoluée.
* les échelles verbales simples (EVS)
Elles utilisent une liste d’adjectifs évoquant une intensité croissante. Par exemple:
> à quatre niveaux : aucune, faible, modérée, intense,
> à cinq niveaux : aucune, faible, modérée, intense, extrêmement intense
En pratique, des adjectifs tels que "faible", "modéré" ou "intense" sont mal compris lorsque les troubles cognitifs sont importants. Nous leur préférons les qualificatifs de "légère", "moyenne", "forte" et "très forte", plus conformes au langage courant.
Aussi longtemps que possible, l'auto-évaluation est la règle car le malade est toujours celui qui connaît le mieux sa douleur.
Les échelles "unidimensionnelles" peuvent convenir à la pathologie douloureuse aiguë du sujet non dément, par exemple en période postopératoire. Chez le patient dont les fonctions cognitives sont dégradées, seules les deux dernières,
en particulier les échelles verbales simples, sont susceptibles de donner une indication valable dont on
devra vérifier la cohérence en cas de doute lors d'un second interrogatoire.
Pour Collins (10), il est
possible d'établir une relation entre l'échelle visuelle analogique et une échelle verbale simple à quatre niveaux : aucune, légère, modérée, sévère. Ces équivalences peuvent être utiles quand l'outil
de référence, l'échelle visuelle analogique, est de réalisation impossible. Cet auteur affirme que, chez des patients soumis à plusieurs études concernant des analgésiques, 85% de ceux qui estimaient leur douleur comme étant "sévère" (344 sujets parmi 1080) avaient un score supérieur à 54 millimètres à l'échelle visuelle analogique. Parmi ceux qui avaient une douleur qualifiée de "modérée" (736 sujets parmi 1080), 85% avaient un score supérieur à 30 millimètres à l'échelle visuelle analogique.
En pratique, les outils utilisés
chez
le sujet complètement incapable de s'exprimer ou dont le langage est incompréhensible se présentent sous la forme de grilles d'hétéro-évaluation
comportementale. En dehors de leur intérêt pour les soins et pour la recherche, elles permettent d’identifier et
de diffuser les items les plus pertinents pour la détection de la douleur et
des inconforts chez la personne âgée démente (11). Ces critères constituent ainsi une base fructueuse pour la formation des aidants. Ils ont aussi l’avantage de valoriser l’observation et la parole des soignants “de base”. Le choix d’un outil effectué, il devra être utilement
distribué aux soignants, aux familles et aux bénévoles.
Citons les deux grilles françaises les plus utilisées :
* le DOLOPLUS-2
(12)
* l’échelle de comportement douloureux chez la personne âgée (ECPA) (13).
Distinguant clairement la période précédant les soins et celle qui leur est contemporaine, l'ECPA nous semble mieux adaptée au sujet âgé grabataire parvenu au stade ultime de la démence : le stade 7 de la Global Deterioration Scale (14).
Figure 3. De l'utilisation des outils :
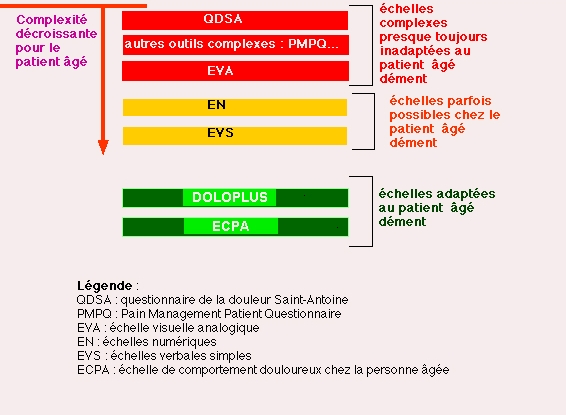
- La localisation des zones douloureuses sur un schéma corporel (15), bien mis en évidence aux yeux de tous les intervenants, permet d'informer tout un chacun afin que nul n'ignore jamais le caractère douloureux d'une manipulation aveugle (16).
L’évaluation du retentissement de la douleur
Le retentissement sur l’humeur : la dimension affectivo-émotionnelle de la douleur.
- La dépression
Les liens entre dépression et douleur chronique sont classiques
et complexes. Il convient toutefois de nuancer encore cette appréciation du fait des relations avec
d'autres comorbidités et symptômes : anxiété, asthénie, dyspnée, polypathologie et incapacités fonctionnelles. Un outil classique d’évaluation de la dépression est l’échelle de dépression gériatrique
(Geriatric Depression Scale), en particulier sous sa forme courte (17). Lorsque la démence s’aggrave, la
mini-GDS
(18)
devient pertinente car seule praticable. A un degré supplémentaire de détérioration, une question unique peut être posée : “vous sentez-vous souvent triste ou déprimé
?” (19). Ces deux derniers adjectifs seront confrontés à des qualificatifs peu
compatibles avec une dépression : gai, content(e), heureux, (heureuse). Pourtant, l’analyse du comportement non
verbal reste souvent la seule valide en fin d’évolution démentielle.
Certains items de la MADRS peuvent alors être utiles (20).
Figure 4. Dépression et douleur.
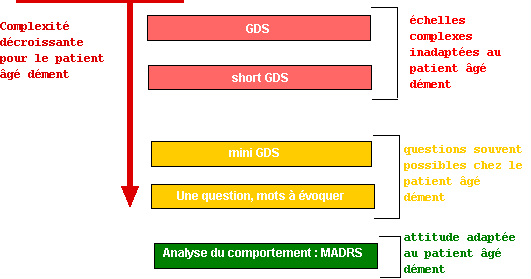
Légende :
GDS : Geriatric Depression Scale (Echelle de dépression gériatrique)
short-GDS : Echelle de dépression gériatrique : forme courte à 15 questions.
mini-GDS : Echelle de dépression gériatrique très courte à 4 questions.
Une question : êtes vous souvent triste ou déprimé ? (traduction de : “are you often sad or depressed ?”)
Mots à évoquer : triste, déprimé, “marre” de la vie, gai, content, heureux.
MADRS : Montgomery-Asberg Depression Rating Scale (voir les items d'hétéro-évaluation)
-
L’anxiété
Pour Casten (21), elle serait plus souvent présente que la dépression en association avec la douleur chez des personnes âgées en institution. Dans notre expérience, l’adjectif “inquiet” est mieux compris que le terme “anxieux”.
Le retentissement fonctionnel
Il doit être distingué du retentissement fonctionnel de la pathologie démentielle. En pratique, la localisation de l’incapacité, sa coexistence temporelle avec la douleur ou encore avec
les autres symptômes d’accompagnement servent d’indice. L’incapacité fonctionnelle est souvent confondue avec la douleur chez la personne âgée démente. Par exemple, l’affirmation de l’incapacité ("je ne peux plus marcher") peut être vécue et annoncée comme une douleur, même lorsque l'atteinte motrice semble seule en cause.
Selon Ferrell(3), la diminution des activités récréatives et sociales serait l’indice le plus fiable de douleur.
L’évaluation de l’efficacité du traitement
La cinétique des scores (EVA, EN, Doloplus-2, ECPA) ou bien l'évolution des qualificatifs de l'EVS prend ici toute sa valeur.
Le traitement ne se conçoit qu'après un diagnostic. Or, il n'est pas toujours aisé de distinguer le "comportement douleur" du comportement lié à d'autres inconforts qui seront minutieusement recherchés : soif, faim, froid, chaleur, bruit, lumière, dyspnée, asthénie, besoins d'élimination, d'être lavé et changé de linge de corps, etc ...
L'apparition d'un tel comportement lors des mouvements actifs ou passifs est un bon indice en faveur d'une causalité algique (22). En cas de doute, un test thérapeutique antalgique est effectué après avoir recherché toutes les causes d'inconforts et de douleur. Ses modalités sont encore mal précisées. L'opiniâtreté et la prudence doivent être de mise : rechercher systématiquement un fécalome ou une rétention urinaire ainsi que les conséquences d'un traumatisme, débuter le test antalgique par le palier 1 de l'OMS.
Le test thérapeutique par un placebo doit être définitivement abandonné, car il n'est pas informatif et aboutit trop souvent au diagnostic sommaire et erroné de douleur psychogène. Si l’on en croit Moore (23), la douleur qui est soulagée par un placebo n’est pas pour autant irréelle. Au contraire, citant Villey, l’auteur déclare : « Attention aux douleurs qui cèdent sous placebo : elles sont certainement organiques ». Dans son expérience, l’auteur affirme qu’il a pu vérifier cette assertion. S’interrogeant sur une explication à ce phénomène, Moore émet l’hypothèse suivante : le patient souffrant d'une douleur « réelle » désire tellement la sédation de sa douleur qu’il se raccroche à tout, y compris au placebo. Par contre, celui qui souffre d'une douleur « psychologique » aurait intérêt au maintien de sa douleur. Aussi contestables soient les termes utilisés par Moore (douleur « réelle » ou « psychologique »), cet auteur a le mérite de prendre le contre-pied des idées toutes faites et persistantes sur l’utilité et la signification du placebo. L’utilisation du placebo est considérée comme non éthique en dehors des essais thérapeutiques par la Société Américaine de Gériatrie (22).
Bibliographie
2- Parmelee PA, Smith B, Katz IR. Pain complaints and cognitive status among elderly institution residents. J Am Geriatr Soc 1993 May;41(5):517-22.
3- Ferrell BA, Ferrell BR, Osterweil D. Pain in the nursing home. J Am Geriatr Soc 1990 Apr;38(4):409-14.
4- Small J. A. Langage et communication dans la maladie d'Alzheimer in Maladie d'Alzheimer et déclin cognitif. Serdi édition, 2002, pp 141-146.
5- Schuler M, Njoo N, Hestermann M, Oster P, Hauer K.
Acute and chronic pain in geriatrics: clinical characteristics of pain and the
influence of cognition.
Pain Med. 2004 Sep;5(3):253-62.
6- Cohen-Mansfield J, Creedon M. Nursing staff members' perceptions of pain indicators in persons with severe dementia. Clin J Pain. 2002 Jan-Feb;18(1):64-73
7- Folstein MF, Folstein SE. Mini-mental state: a practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975;12:189-198
8- Boureau F, Doubrère JF, Luu M. Les méthodes d’évaluation de la douleur en clinique. In La Douleur Chronique, Simon J, Roquefeuil B, Pélissier J. Ed. Masson, 1985, pp 37-42.
9- Scherder EJ, Bouma A.
Visual analogue scales for pain assessment in Alzheimer's disease.
Gerontology. 2000 Jan-Feb;46(1):47-53.
10- Collins SL, Moore RA, McQuay HJ. The visual analogue pain intensity scale: what is moderate pain in millimetres? Pain 1997 Aug;72(1-2):95-7.
11- Pradines V. Pradines B. L’agitation chez le dément non verbalisant : penser à la douleur. Psychologie & NeuroPsychiatrie du vieillissement. Numéro 2, volume 4, 271-4, décembre 2004, Synthèse.
12- Site du Doloplus-2 accessible le 10 juin 2005 à l'adresse : www.doloplus.com
13- ECPA accessible le 10 juin 2005 à l'adresse : http://geriatrie-albi.com/ECPA.html
14- Reisberg B, Ferris SH, de Leon MJ, Crook T. The Global Deterioration Scale for assessment of primary degenerative dementia. Am J Psychiatry 1982 Sep;139(9):1136-9
15- Schéma corporel accessible le 10 juin 2005 à l'adresse : http://geriatrie-albi.com/bonhommedouleur.html
16- Pradines B, Manteau R, Hamié W. Prise en compte de la douleur chez les personnes âgées : de multiples obstacles. Gériatries. Septembre/Octobre 1999, n° 16, pp 16-20
17- Forme courte de la Geriatric Depression Scale accessible le 10 juin 2005 à l'adresse : http://geriatrie-albi.com/shortGDS.html
18- Forme mini de la Geriatric Depression Scale accessible le 10 juin 2005 à l'adresse : http://geriatrie-albi.com/mini-GDS.html
19- Mahoney J, Drinka TJ, Abler R, et al. Screening for depression: single question versus GDS. J Am Geriatr Soc 42:1006, 1994.
20- Traduction indicative de la Montgomery-Asberg Depression Rating Scale (MADRS) accessible le 10 juin 2005 à l'adresse : http://geriatrie-albi.com/MADRSdetails.htm
21- Casten RJ, Parmelee PA, Kleban MH, Lawton MP, Katz IR. The relationships among anxiety, depression, and pain in a geriatric institutionalized sample. Pain 1995 May;61(2):271-6.
22- AGS Panel on Persistent Pain in Older Persons. The management of persistent pain in older persons. J Am Geriatr Soc. 2002 Jun;50(6 Suppl):S205-24.
23- Moore N. Placebos in medicine: Pain that is relieved by placebo is not therefore unreal. BMJ 2005;330:45, doi:10.1136/bmj.330.7481.45-c
24- Marzinski LR. The tragedy of dementia: clinically assessing pain in the confused nonverbal elderly. J Gerontol Nurs 1991 Jun;17(6):25-8.
Ecrivez à l'auteur :
pour Bernard Pradines
