
Dernière mise à jour le 19 novembre 2025
Retour à la page d’accueil du site : https://www.geriatrie-albi.fr
Retour la page sommaire des douleurs chez la personne âgée
La bibliographie relative à cette page est incluse dans l'ordre alphabétique des auteurs à l'adresse suivante : https://geriatrie-albi.com/Douleurbibliographie.htm
Plan du chapitre
A. La détection
B. L'évaluation proprement dite
C. En résumé
A. La détection
Rappel. Les références bibliographiques sont situées à la page suivante : http://geriatrie-albi.com/Douleurbibliographie.htm
Avant toute évaluation, il convient d'abord de déceler l'existence d'une douleur spontanée ou provoquée, déclarée par la personne ou bien par toute personne de l’entourage, qu’elle fasse partie de l'équipe soignante, de la famille du patient ou des bénévoles (Pradines B. 1999). Une grande difficulté est due aux troubles sensoriels et surtout cognitifs, en particulier aux troubles mnésiques.
Pour Sengstaken (Sengstaken et al, 1993), il est possible de détecter une douleur chez 43 % chez des patients aptes à communiquer. Par contre, ce pourcentage est ramené à 17 % chez ceux qui ont des altérations cognitives telles qu'ils ne sont pas capables de communiquer avec autrui.
Les patients atteints de démence avancée peuvent présenter un risque substantiel de douleur non détectée ou insuffisamment traitée. A noter que le terme de démence, fort décrié et souvent incompris, renvoie à son étymologie latine (demens, tis) dont le premier sens d’après Gaffiot 1934 est le suivant : perte des fonctions intellectuelles. Au décours d’une fracture de hanche, Morrison (Morrison et Siu, 2000) étudie 59 patients âgés cognitivement intacts et 38 autres souffrant de démences avancées. Pour examiner le traitement de la douleur après une fracture de la hanche, une étude de cohorte prospective a été menée dans un hôpital universitaire. Les patients ont été évalués quotidiennement. Les patients cognitivement intacts ont autoévalué leur douleur sur une échelle numérique allant de 0 (aucune) à 4 (très sévère). Les analgésiques prescrits et administrés ont été répertoriés et comparés à ceux des patients ayant une fracture de la hanche atteints de démence avancée. Les patients atteints de démence avancée ont reçu un tiers de la quantité d'équivalents sulfate de morphine par rapport aux patients cognitivement intacts. 44% des personnes cognitivement intactes ont signalé une douleur sévère à très sévère en phase préopératoire et 42% ont signalé une douleur de même intensité en phase postopératoire. La moitié des patients cognitivement intacts qui ont ressenti une douleur modérée à très sévère se sont vu prescrire une analgésie inadéquate pour leur niveau de douleur. 83% des patients cognitivement intacts et 76% des patients atteints de démence n'ont pas bénéficié d’une prescription permanente d’un analgésique. Ces données révèlent que la majorité des patients âgés ayant subi une fracture de la hanche ont présenté une douleur insuffisamment traitée. Le fait que les patients atteints de démence avancée aient reçu un tiers de la quantité d'analgésiques opioïdes par rapport aux sujets cognitivement intacts - dont 40% ont signalé une douleur intense en postopératoire - suggère que la majorité des patients atteints de démence présentaient une douleur intense en postopératoire. Cette étude et d'autres fournissant des résultats similaires suggèrent que des interventions dirigées vers l’amélioration de la détection de la douleur et la modification des pratiques de prescription chez les déficients cognitifs sont nécessaires.
La douleur est le plus souvent provoquée lors des soins, qu’ils soient qualifiés de techniques ou de nursing. La plainte, recherchée systématiquement, doit être écrite et transmise au médecin. La qualité de la manipulation et de la manutention des patients revêtent un caractère incontournable dans la prévention des douleurs liées aux mobilisations. La détection des localisations douloureuses est le préalable obligé d’une prise en charge de qualité car une localisation douloureuse préalable va se réveiller ou s’aggraver à la faveur des gestes de soins. En effet, l'évaluation de la douleur ne se conçoit que pour une douleur identifiée et localisée. Cette détection nécessite une sensibilisation de tous les intervenants (soignants, familles, bénévoles) par une formation adéquate à l’observation des patients et une volonté quotidienne d'alléger leurs souffrances. Dans ce contexte, les grilles d'hétéroévaluation peuvent être utiles, en dehors de leur utilisation habituelle, par une large diffusion. Elles mettent en exergue les items les plus pertinents dans la mise en évidence d'une ou de plusieurs localisations douloureuses. Les exemples de la CNPI et de l’Algoplus peuvent être utiles car ils peuvent être compris de tout le monde.
De manière courante, le renseignement systématique d’une grille d’hétéroévaluation de la douleur est recommandé après l’entrée du résident en établissement. En cas de doute, il semble préférable de rassembler les observations des divers intervenants que de faire confiance à une grille renseignée immédiatement après l’entrée, sans véritable appréciation plurielle préalable.
L’évaluation est encore trop souvent oubliée ou repose sur des critères purement empiriques. Ainsi, nous, soignants, attacherions-nous davantage d’importance à l’altération fonctionnelle plutôt qu’aux scores de douleur côtés par le patient. C’est ce que nous suggère une publication (Rebecca B. et al, 2014) issue d’un département britannique de médecine palliative sous le titre : « nous parlons tous d’elle [la douleur] comme si nous pensions à la même chose. Les objectifs des professionnels de santé dans la prise en charge de la douleur liée au cancer avancé : une étude qualitative ». En effet, les observations issues de l’entourage soignant, familial ou bénévole, peuvent être différentes voire contradictoires. Cette appréciation rejoint mon expérience clinique ; la douleur est souvent jugée à l’aide de son retentissement sur les capacités fonctionnelles du patient, davantage que sur la parole de ce dernier. Par exemple : « il ne peut plus marcher » ou bien : « il ne peut plus se servir de son membre supérieur gauche ».
En somme, il s'agit ici d'un travail d'équipe au sens large du terme qui nécessite une information écrite, réciproque et permanente. Le médecin ne peut pas du fait de sa présence éphémère, presque toujours en dehors des soins nécessitant une mobilisation ou des gestes douloureux, avoir à lui seul une vision correcte de la situation douloureuse. De plus, aucun médicament antalgique ne pourra avantageusement remplacer une manipulation et une manutention douces. Pour utiliser une comparaison triviale, il ne faut pas se contenter d'une simple photographie effectuée par le médecin mais il convient d’envisager la confrontation de plusieurs films en provenance de l'ensemble des observateurs. Ces films devront être connus de tous. Le défi est d’abord là !
1. La recherche des antécédents douloureux :
L'évaluation
de la douleur par la famille du résident et la connaissance
des antécédents algiques sont utiles dans la détection
de la douleur chez les personnes âgées cognitivement
détériorées. Autrement dit, les douleurs ne
disparaissent pas avec le développement des troubles
cognitifs.
Selon l'étude publiée par
Cohen-Mansfield (Cohen-Mansfield, décembre 2002), à
l’instar des autres observateurs, la famille a davantage de
difficulté pour évaluer la douleur quand le résident
souffre d'une détérioration cognitive sévère.
Selon cet auteur, l'évaluation ne serait pertinente que
si le parent effectue des visites régulières dans
l’établissement, en particulier quand celles-ci ont lieu
au moins une fois par semaine et lors du début du séjour
en établissement.
Dans notre expérience, la famille est souvent la meilleure source de renseignements relatifs aux localisations douloureuses habituelles, en particulier celles qui étaient préalables à l’entrée en établissement. Il convient donc de s’en entretenir avec elle, en particulier à l‘aide d’un schéma corporel et par la recherche d’antécédents douloureux : pathologie articulaire, intervention chirurgicale, etc.
2. Les conditions de l'interrogatoire du patient, quand il est possible, sont importantes :
La désorientation temporelle est souvent génératrice de confusion dans les conjugaisons des verbes : "j'ai mal" peut signifier "j'ai eu mal" ou encore "je suis mal". La précision par les questions "et maintenant, avez-vous mal ?" ou bien "avez-vous mal en ce moment ?" est indispensable.
D'une façon générale, les questions devront être :
- claires : utilisant un vocabulaire simple,
- courtes : avez-vous mal ? Où avez-vous mal ? Comment cela fait-il mal ? Depuis quand avez-vous mal ?
- positives : "avez-vous mal?" plutôt que "n'avez-vous pas mal ?", ou bien "cela brûle-t-il » au lieu de "cela nous brûle-t-il pas ?"
Par ailleurs :
- le soignant se situe face au patient, assis à sa hauteur, dans une ambiance silencieuse, en prenant son temps,
- le visage du soignant doit être éclairé,
- les mots sont articulés et distingués entre eux,
- les localisations suspectes sont désignées gestuellement par le soignant en demandant au patient de désigner les zones évoquées : "montrez-moi où vous avez mal !"
- l'intensité de la douleur peut être évoquée en faisant un geste ascendant sur une échelle visuelle et verbale virtuelle : un peu, moyen, beaucoup ?
- en variant les interrogateurs : certains soignants ou certaines voix "passent" mieux que d'autres.
Afin de préciser l'urgence thérapeutique et donc les risques thérapeutiques encourus, il est utile de compléter cet interrogatoire par les questions suivantes :
- êtes-vous soulagé(e) par une position particulière ?
- la douleur est-elle supportable ?
- voulez-vous un nouveau médicament ou davantage de médicaments contre la douleur ?
3. Les variations du comportement sont les meilleurs indices de l’apparition ou de l’aggravation d’une douleur chez un malade incapable de s'exprimer verbalement. On attachera beaucoup d'importance au faciès, aux vocalisations non verbales, à la crispation, à l'agitation et à l'opposition aux soins. La simple évocation de la douleur par l'entourage ou une attitude suspecte chez une personne âgée démente doit être interprétée comme une possibilité de douleur.
4. L'examen clinique du patient dément parvenu à l'absence de communication verbale doit être aussi systématique et soigneux que celui qui est réservé aux polytraumatisés.
En effet, l'interrogatoire et la recherche des antécédents douloureux ainsi que des situations potentiellement douloureuses doivent être complétés par un examen clinique approfondi.
La douleur sera recherchée systématiquement, appareil par appareil. Deux appareils méritent une mention particulière :
- l'appareil ostéo-articulaire qui devra être exploré articulation par articulation, voire zone par zone. C'est le cas du rachis.
- la peau à la recherche des escarres débutantes. Les escarres talonnières représentent une fréquente source de douleurs. Elles sont plus fréquemment douloureuses que les escarres sacrées. Les escarres ont parfois une localisation moins fréquente : bord externe du pied, malléoles, etc. La détection des escarres au stade 1 représente une prévention efficace d'une cause habituelle de douleurs. Lire sur ce site : protocole pour la prise en charge des escarres au stade 1
B. L'évaluation proprement dite
Quels sont les éléments d'appréciation quantitative à notre disposition ?
Et d'abord, un peu de vocabulaire : plusieurs termes sont utilisés à propos des outils d'évaluation :
échelle pour l'autoévaluation |
échelle permettant l'évaluation de la douleur par le patient lui-même. Pour notre part, nous serions tentés d'ajouter l'adjectif "assistée" à autoévaluation, tant est fréquente la participation de l'observateur à l'autoévaluation. |
échelle pour l'hétéroévaluation |
échelle destinée à l'évaluation de la douleur par l'observateur et non par le patient |
échelle multidimensionnelle |
échelle qui est censée analyser les diverses composantes de la douleur. Par exemple le QDSA en France. |
échelle unidimensionnelle |
échelle mesurant en théorie l'intensité de la douleur. Par exemple l'EVA (échelle visuelle analogique). En fait la réalité est bien plus complexe que ne le suggère le terme « unidimensionnelle ». |
échelle générique (Tsai et al. 2003) |
échelle destinée à tous les types de douleurs : par exemple l'EVA, l'EN (échelle numérique) ou l'EVS (échelle verbale simple). |
échelle spécifique |
échelle destinée à une pathologie spécifique : par exemple la gonarthrose ou la coxarthrose ou encore les douleurs neuropathiques (DN4, LANSS) |
1. L'envahissement du discours par la plainte douloureuse constitue un indice évident, quantitatif et qualitatif. Toutefois, ce symptôme rend difficile une appréciation plus subtile. Le patient est alors dans une situation d'urgence. Tout dialogue élaboré est aléatoire. Une deuxième évaluation après traitement est indispensable. Dès que les fonctions cognitives sont très dégradées, la plainte douloureuse peut devenir méconnaissable et se traduire autrement, en particulier par un changement de comportement en relation avec les circonstances douloureuses.
Pour Stein (Stein, 2001), des changements de l'état mental de base sont peut-être le meilleur indice d'un problème douloureux potentiel.
2. Le Questionnaire du type Mac Gill : QDSA (Questionnaire de la Douleur Saint-Antoine) (Boureau et al, 1992). Il est rarement praticable dans ce contexte du fait de sa complexité sémantique. Il est de pratique impossible chez le patient dément.
3. Les échelles dites "unidimensionnelles"
3.1) L'Echelle Visuelle Analogique (EVA) se présente sous la forme d'une réglette munie d'un curseur (exemple). Le patient sera invité à déplacer ce curseur d'une extrémité de la ligne "pas de douleur" vers l'autre extrémité : "douleur insupportable" ou bien "pire douleur imaginable " ou encore "douleur maximale imaginable". Au dos de la réglette figure généralement une échelle numérique graduée de 0 à 100 permettant au soignant une cotation chiffrée par le soignant. Cette évaluation est troublée par les troubles cognitifs faisant souvent confondre l'intensité de la douleur et sa localisation, par les troubles de la vision et par l'incrédulité de certains patients ou même de certains soignants. Elle est parfois utilisée comme un outil d'hétéroévaluation dans ce contexte du grand âge. En cas de difficulté, il convient de recourir à une échelle numérique, puis à une échelle verbale. Chez 79 patients d'âge moyen 82,6 ans évalués à l'entrée en court séjour gériatrique, Molines (Molines et al, 2002) estime que l'EVA semble mesurer les variations de la douleur physique, mais aussi psychique. Sans détailler ses observations, Molines note, pour certains patients, une diminution significative de la douleur par la prescription d'un psychotrope ou d'un soutien psychologique. Les auteurs posent la question suivante : doit-on répondre obligatoirement par un traitement antalgique à toute symptomatologie douloureuse repérée par la passation d'une EVA ?
Malgré sa dénomination d'unidimensionnelle, l'EVA est bien une échelle globale explorant les diverses dimensions de la douleur. Elle ne préjuge pas de la conduite à tenir précise dans le domaine thérapeutique.
En 2000, Scherder (Scherder et Bouma, 2000) compare trois échelles visuelles analogiques dans le but d'éviter l'écueil de l'altération du langage dans les démences :
- une échelle visuelle analogique colorée,
- une échelle de faciès mesurant la douleur,
- une échelle de faciès mesurant la dimension affective.
Les personnes âgées présentaient par ailleurs :
- soit des fonctions cognitives normales,
- soit un stade léger de maladie d'Alzheimer,
- soit un stade modéré de maladie d'Alzheimer.
L'échelle visuelle analogique colorée était comprise par toutes les personnes interrogées, quel que soit leur état cognitif. Par contre, les échelles faciales étaient d'autant moins comprises que le stade de la démence était avancé pour atteindre respectivement 20% et 30% dans les stades modérés.
En gériatrie courante auprès de patients souffrant de démences modérées ou avancées, l'EVA perd de son intérêt habituel. Elle exige des capacités intellectuelles d'abstraction. Suite à une première consigne d'utilisation, les résultats sont souvent ininterprétables, du fait d'une mauvaise compréhension du concept.
Ainsi, la spécificité de l'EVA paraît mauvaise puisque ce n'est pas l'intensité douloureuse qui est évaluée mais :
- la localisation de la douleur : cotation à gauche sur la ligne, positionnée horizontalement, en cas de phénomène douloureux situé à gauche du corps et inversement. Même erreur pour une représentation corporelle de haut en bas lorsqu'elle est présentée verticalement.
- le déclenchement de la douleur : le malade peut penser que le déplacement du curseur ou que l'application de l'instrument sur la zone douloureuse va entraîner l'apparition de sa douleur.
- enfin la gêne fonctionnelle, c'est-à-dire les conséquences motrices de la douleur. La fiabilité inter-juge et intra-juge n'a pas été étudiée. Autre biais, le qualificatif inscrit pour définir l'intensité maximale varie selon les réglettes, par exemple "insupportable" ou bien "atroce" ou encore "douleur maximale imaginable" : le choix du vocabulaire interfère donc avec la cotation.
3.2) Les échelles numériques (EN) : les échelles numériques (exemple) sont le plus souvent graduées de 0 à 10 ou de 0 à 100 en fonction de l'intensité de la douleur. Ces échelles sont intéressantes chez les personnes âgées ne souffrant pas de détérioration cognitive sévère.
Les échelles EVA et EN conviennent surtout à la pathologie aiguë du sujet non dément, par exemple en période post-opératoire.
3.3) L'échelle de douleur utilisant des visages a été surtout employée en France chez l'enfant. Chez la personne âgée, la corrélation avec l'intensité de la douleur serait moins bonne avec cet outil par rapport aux échelles de mesure utilisées habituellement : EVA, EN, EVS. Cette moindre sensibilité serait liée aux composants affectifs des représentations faciales : colère, ennui, anxiété.
Exemple d'échelle utilisant les visages (réglette diffusée par le laboratoire UPSA) :
3.4) Les échelles verbales simples (EVS) à quatre ou cinq niveaux (exemple) : dans notre expérience, elles sont les dernières échelles d'auto-évaluation utilisables avant de recourir à l'hétéroévaluation lorsque la démence s'aggrave (Pradines B (1), 1999).
La pratique courante d’association de plusieurs échelles, verbale simple et numérique comme dans l’exemple précédent, ci-dessus, est discutable car les intervalles ne sont pas similaires. Notre propre échelle verbale simple est questionnable de ce point de vue par sa correspondance analogique (thermomètre de la douleur).
Chez le patient dément, les EVS sont souvent les seules échelles susceptibles de donner une indication valable qui devra être vérifiée en cas de doute lors d'un second interrogatoire.
Nous recommandons une EVS à cinq niveaux sans correspondance numérique. Les termes de l'EVS doivent être judicieusement choisis pour être compris par la personne âgée présentant des troubles cognitifs :
- douleur "nulle", "faible", "modérée", "intense" et "très intense", "sévère" et "très sévère" sont des termes peu évocateurs, inhabituels, souvent mal ou pas compris par nos interlocuteurs.
Par expérience, même en l'absence de validation, nous leur préférons empiriquement les mots les plus simples, les plus habituels, les mieux ancrés dans le langage courant. Nous expliquons éventuellement qu'une douleur "très forte" peut être considérée comme maximale, la pire douleur imaginable :
très forte |
forte |
moyenne |
légère |
aucune douleur |
Par convention personnelle, afin de la distinguer des autres EVS, nous proposons de dénommer l'EVS que nous utilisons depuis 2002 du nom de notre ville : EVS-Albi. Nous l'employons sous la forme d'une grille de surveillance avec d'une part une mesure au repos et d'autre part une mesure lors des mouvements et des soins qui correspond le plus souvent à la douleur maximale enregistrée.
Cette approche semble corroborée par Ferrel (Ferrell et al. 1995) qui étudie l'évaluation de la douleur chez des personnes âgées cognitivement détériorées dont le MMS moyen est de 12. L'échelle la plus pertinente est, de la même façon, une échelle utilisant des adjectifs qualificatifs.
Wynne (Wynne et al. 2000) corrobore ces résultats au décours d'une étude portant sur 103 résidents qui sont interrogés chaque mois pendant un an sur la sévérité et la localisation de leurs douleurs. Parmi les résidents dont le MMSE était inférieur à 15, les meilleurs outils étaient les suivants :
- pour la sévérité de la douleur : des adjectifs qualificatifs (mots) préférables à l'échelle numérique, à l'échelle visuelle analogique et à l'échelle des faciès.
- pour la localisation de la douleur : la désignation sur soi-même plutôt que sur un schéma corporel ou sur une poupée.
Pour Collins (Collins et al, 1997), il existe une relation entre l'EVA (Echelle Visuelle Analogique) et une échelle verbale à quatre niveaux : aucune, légère, modérée, sévère. Cet auteur affirme que, chez des patients soumis à plusieurs études concernant des analgésiques, 85% de ceux qui estimaient leur douleur comme étant "sévère" (344 sujets parmi 1080) avaient un score supérieur à 54 mm à l'EVA. Parmi ceux qui avaient une douleur qualifiée de "modérée" (736 sujets parmi 1080), 85% avaient un score supérieur à 30 mm à l'EVA. Ces équivalences pourraient être utiles quand l'EVA est impossible, situation fréquente en gériatrie.
KA Herr (Herr et al. 2004) confirme par une étude comparative entre sujets adultes jeunes et âgés que l'EVS est l'outil le plus adapté à la personne âgée, y compris chez celle qui souffre de troubles cognitifs légers ou modérés.
Lors de l'application d'un stimulus mécanique identique chez des personnes âgées hospitalisées, 46 % seulement des patients parviennent à utiliser correctement l'EVA, 73 % l'EN et 76 % l'EVS. (François et al. 2004)
Trois personnes sur quatre utilisent correctement l’EVS ou l’EN pour un stimulus de pression, que ces personnes soient atteintes d’une démence légère ou modérée (MMSE supérieur à 24 ou bien compris entre 18 et 23). Les auteurs concluent par ailleurs que l'EVA semble d’un maniement trop difficile pour les personnes âgées étudiées.
Cette étude renforce notre pratique fondée sur l'EVS et l'EN dans un contexte où l'autoévaluation, même assistée, demeure toujours plus pertinente que l'hétéroévaluation. Les études publiées sur les corrélats entre la douleur subjective et l'imagerie fonctionnelle cérébrale vont dans ce sens (Coghill et al. 2003) (Koyama et al. 2005).
L’EVS proposée par Tremblay Nguyen (Tremblay Nguyen et al, 2012) est la suivante : douleur absente, faible, modérée, forte, très forte. Pour notre part, nous avons conseillé ci-dessus les mots qui nous semblent empiriquement les mieux compris : aucune douleur, légère, moyenne, forte, très forte à compléter par la notion de supportable ou d’insupportable.
L’EVS étant l’outil le plus adéquat quand il est réalisable, une étude future demeure indispensable pour déterminer les mots français les mieux compris par les personnes âgées, en particulier par celles qui souffrent de troubles cognitifs.
3.5) Particularités de l'interrogatoire
J.A. Small étudie le langage et la communication dans la maladie d'Alzheimer en observant et évaluant les stratégies utilisées par les aidants. Je me suis inspiré de ces études pour préciser notre propre attitude dans ces situations.
1. Éliminer les facteurs de distraction, par exemple la télévision ou la radio. Au mieux, le dialogue aura lieu seul à seul dans une chambre ou un bureau.
2. S'approcher de la personne lentement et de face, créer et maintenir un contact visuel avec le regard du malade. On se placera de préférence au même niveau que le malade, le plus souvent en position assise. Le visage de l’observateur est éclairé par la lumière. Il convient aussi que demeurer dans le champ visuel de la personne interrogée. Pour cela, il faut se situer au mieux au centre du champ visuel présumé. En effet, le rétrécissement du champ visuel se combine souvent aux difficultés de rotation du rachis cervical chez les personnes très âgées.
3. Utiliser des phrases simples et les plus courtes possibles, comportant les mots les plus simples. Les questions positives sont mieux comprises. Par exemple : "avez-vous mal ?" plutôt que : "n'avez-vous pas mal ?"
4. Poser une seule question ou ne donner qu'une seule instruction à la fois. En pratique attendre la réponse avant de poser une autre question.
5. Poser des questions fermées qui appellent une réponse par "oui" ou par "non". Si l'on doit recourir à des questions ouvertes, celles qui font appel à la mémoire sémantique sont mieux comprises que celles se référant à la mémoire épisodique (Small J.A., 2005).
6. Répéter les messages en utilisant les mêmes mots, mot à mot, en articulant bien. Pour résumer, le langage du "prêtre dans son église" me semble opérant.
7. Reformuler les messages en utilisant des paraphrases (selon l'Encyclopædia Universalis 2004, pour notre propos, "paraphrase" : développement explicatif d'un texte, amplification verbeuse d'un texte, synonyme).
8. Éviter d'interrompre la personne et lui accorder tout le temps nécessaire pour répondre.
9. Encourager la personne à approcher verbalement ou à décrire le mot qu'il est en train de chercher, encourager les circonlocutions (selon l'Encyclopædia Universalis 2004, "circonlocution" : façon de parler par périphrases, de manière indirecte. "Périphrase" : remplacement d'un mot par une expression ayant le même sens, façon d'exprimer sa pensée de manière indirecte).
10. Parler lentement. Cette attitude semble toutefois moins performante que la répétition et l’utilisation de paraphrases (Small J.A., 2003).
A tort ou à raison, je tente d'imiter l'accent du résident quand il en possède un, par exemple celui de Paris (chacun sait que nous n'avons aucun accent dans le Sud-Ouest de la France).
Les stratégies qui ont montré selon J.A. Small une amélioration de la communication sont l'élimination des éléments de distraction et la simplification de la structure de la phrase et des questions. Ces données semblent plaider en faveur d'une EVS (échelle verbale simple) qui serait la plus simple possible.
3.6) Une échelle qui combine les éléments des échelles unidimensionnelles :
Le thermomètre de la douleur est une variante qui associe l'EVS à une EVA et/ou à une EN, le tout en forme de thermomètre. Cette évocation est parlante à la fois pour le résident et pour le soignant qui procède à l'évaluation. Choiniere (Choiniere et al, 1994, 1996) étudie cet outil dans un centre de brûlés en indiquant en conclusion que le thermomètre est un moyen utile, valide et précis pour mesurer la douleur. Benesh (Benesh et al, 1997) parvient à une conclusion comparable chez des femmes âgées en institution. Cet auteur affirme que le thermomètre de la douleur est le meilleur indicateur de la douleur chez des femmes âgées en milieu rural, en sus de sa facilité d'administration. Weiner (Weiner et al, deux publications en 1998) l'utilise aussi.
A noter que l'utilisation par Benesh et Weiner diffère sensiblement de celle de Choiniere. Pour Benesh et Weiner, le thermomètre est une combinaison d'échelle verbale simple, d'échelle visuelle analogique et d'échelle numérique. Celui de Choiniere se rapproche davantage de l'échelle visuelle analogique.
L'utilisation d'un tel outil comporte toutefois le risque d'une discordance entre l'EVS, l'EN et l'EVA ainsi représentées. Pour notre part, nous y préférons la comparaison entre deux outils présentés séparément, le plus souvent l'EN et l'EVS.
4. Les échelles spécifiques
Par exemple :
· l'échelle de Lequesne pour les gonarthroses (Société Française de Rhumatologie, accès le 22 août 2020)
· l’échelle d’incapacité d’Oswestry (ODI) pour les lombalgies (traduction en français par l’Agence fédérale belge des risques professionnels)
· l'échelle DN4 pour les douleurs neurogènes (encore qualifiées de neuropathiques)
5. Les échelles d'hétéroévaluation
Ce type d'évaluation est indiqué chez les patients non verbalisants ou incapables de renseigner une autoévaluation, même si elle est assistée par l'observateur. Le stade 7 de la classification de Reisberg (Reisberg et al, 1982) constitue le plus souvent le cadre sémiologique de cette situation clinique : toutes les capacités verbales sont perdues au cours de ce stade. Souvent, aucun langage n'est présent, seulement des expressions inintelligibles et la rare émergence de phrases et de mots apparemment oubliés. Il existe une incontinence urinaire ainsi que la nécessité d'assistance à la toilette et au repas. Les capacités psychomotrices basiques, par exemple la capacité à marcher, sont perdues avec la progression de ce stade. Le cerveau n'apparaît plus capable de dire au corps ce qu'il faut faire. La rigidité généralisée et des réflexes neurologiques élémentaires sont souvent présents.
Une surdité totale, plus encore qu'une cécité bilatérale, peut compromettre toute auto-évaluation, même aidée par l'observateur.
Ainsi, il est possible de distinguer trois stades (classification personnelle) qui peuvent, à l'intérieur du stade 7 de la classification GDS de Reisberg (global deterioration scale), modifier l'hétéroévaluation de la douleur :
- le malade déambule et a conservé des capacités fonctionnelles des membres supérieurs et une vocalisation : stade 1.
- le malade est grabataire, va au lit et au fauteuil de manière passive, mais a conservé des capacités fonctionnelles des membres supérieurs et une vocalisation : stade 2.
- le malade est grabataire, il souffre de contractures et d'ankyloses multiples, les capacités motrices sont limitées à des mouvements réduits dans l'espace. Toute vocalisation peut être inexistante : stade 3.
5.1) Le DOLOPLUS (Wary B. et coll (1-2)
On pourra se rapporter à la page : http://www.doloplus.fr/lechelle-doloplus/
et à l’échelle : http://www.doloplus.fr/pdf/doloplus-fr.pdf
Les 10 items de cette échelle sont regroupés sous 3 grands chapitres :
5.1.1
- le retentissement somatique
5.1.2 - le retentissement
psychomoteur
5.1.3 - le retentissement psychosocial
Le
collectif Doloplus a publié un DVD en 2003 sur le thème
: "Et si c'était la douleur ?" Il détaille,
item par item, la cotation de cette échelle auprès de
malades présentant des comportements compatibles avec une
douleur. Il existe aussi une cassette VHS, différente dans son
contenu, un peu plus ancienne.
Renseignements :
zidetzen@club-internet.fr
Le
Doloplus comporte 10 items allant de 0 (minimum) à 3 (maximum)
soit 40 possibilités.
5.1.1
- le retentissement somatique
a)
Plaintes somatiques :
Commentaire
de l'auteur de ce site : elles sont malheureusement peu explicites
sur la localisation et l'intensité de la douleur.
b)
Positions antalgiques au repos :
Commentaires
de l'auteur de ce site : c'est un critère peu pertinent chez
le grabataire qui n'a pas souvent le choix de sa position. Par
contre, cet élément peut être utilisé
comme une thérapeutique.
c)
Protection de zones douloureuses
Commentaires
de l'auteur de ce site : elle nécessite des capacités
cognitives, praxiques et l'absence d'incapacité locomotrice
telles qu'une hypertonie ou une ankylose.
d)
Mimique
Commentaires
de l'auteur de ce site : peut-être l'élément le
plus intéressant. Cet intérêt est limité
en cas de faciès figé : Parkinson, paralysie faciale.
Au mieux, une deuxième personne doit se disposer en
observateur du visage au moment de la mobilisation et des soins.
Sinon, l'utilisation d'un miroir doit être envisagée.
L'expression faciale de la douleur représente un ensemble de réactions motrices pertinentes dans la suspicion d'un phénomène douloureux, tout particulièrement chez les personnes âgées non verbalisantes.
Des équipes canadiennes, tout particulièrement, ont travaillé sur ce sujet.
En 1985, Craig (Craig et al. 1985) étudie l'expression faciale consécutive à une douleur expérimentale chez des femmes volontaires par l'application de froid. L'analyse des réactions utilisait le FACS (Facial Action Coding System).
D'une part, les signes observés étaient les suivants :
- rétrécissement de l'ouverture des yeux par élévation de la paupière inférieure,
- élévation de la lèvre supérieure,
- traction sur les commissures labiales,
- ouverture des lèvres ou chute de la mandibule,
- fermeture des yeux ou clignotements des paupières.
L'auteur tempère toutefois ses conclusions en affirmant d'une part que les variations individuelles sont importantes. D'autre part, les réactions faciales sont plus nettes au début de la stimulation douloureuse et tendent à s'atténuer, même si l'intensité subjective de la douleur augmente.
En
2003, Manfredi (Manfredi et al. 2003) publie une étude
originale dont le but est d'évaluer la fiabilité et la
validité des expressions faciales comme indicateurs de la
douleur chez des patients souffrant de démence sévère.
Se fondant sur des interviews de patients qui pouvaient
rendre compte de leur douleur, les auteurs ont défini les
caractéristiques des escarres douloureuses lors de la
réfection du pansement.
Puis ils évaluèrent
9 malades souffrant d'escarres comparables mais qui étaient
incapables de communiquer verbalement du fait d'une démence
sévère.
Enfin, ils filmèrent les
expressions faciales avant et pendant la réfection du
pansement d'escarre. Les enregistrements filmés sont projetés
dans un ordre aléatoire devant 8 étudiants en médecine
et 10 infirmières.
Les 18 observateurs étaient
invités à attribuer la présence ou non de
douleur à partir des expressions faciales et des
vocalisations.
En conclusion, les auteurs indiquent que
l'observation des expressions faciales et des vocalisations est un
moyen efficace pour évaluer la présence de la douleur,
mais non son intensité, chez des patients incapables de
communiquer verbalement du fait de leur démence évoluée.
e)
Sommeil
Commentaire de l'auteur de ce site : l'observation
est souvent le fait des équipes de nuit, d'où la
nécessité d'une formation et d'une implication de ces
équipes.
5.1.2 - le retentissement psychomoteur
a)
Toilette et habillage
Commentaires de l'auteur de ce site :
bon signe bien que peu spécifique. Il s'agit plutôt
d'une occasion de découvrir une zone douloureuse. La peur, en
particulier la peur de tomber hors du lit, peut en imposer pour une
plainte douloureuse surtout si le patient n'est pas averti de ce qui
va se passer ou bien redoute tout simplement les manipulations.
b)
Mouvements
Commentaire de l'auteur de ce site : bon signe
bien que peu spécifique.
5.1.3 - le retentissement psychosocial
a)
Communication
Commentaire de l'auteur de ce site : bon signe
bien que peu spécifique.
b)
Vie sociale
Commentaire de l'auteur de ce site : signe
intéressant dans les cas de participation habituelle à
la vie sociale.
c)
Troubles du comportement
Commentaires de l'auteur de ce site
: la douleur est possiblement à l'origine de nombreux troubles
du comportement. Certains ont pu proposer une stratégie en
deux temps : devant un patient qui crie de façon inexpliquée,
une première ligne thérapeutique est représentée
par un morphinique, une deuxième ligne par un antidépresseur.
Le traitement de la douleur pourrait alors apporter un soulagement de
ces troubles. Pour notre part, de manière plus empirique, nous
avons souvent constaté une diminution de l'opposition aux
soins sous analgésique(s). A propos du "test
antalgique" : un test utilisant le paracétamol, premier
palier de l'OMS, nous semble judicieux, surtout par l'absence d'effet
sédatif lié aux opioïdes. Ce dernier aspect
est important : il est parfois très difficile de faire la
part de l'effet sédatif et de l'effet analgésique chez
un patient dément opposant ? Autrement dit la part de
l'anxiété et de la douleur. Seule l'administration d'un
sédatif non analgésique permettra de trancher le débat.
Pour les concepteurs du Doloplus, lorsque les trois derniers items de la grille sont seuls concernés, la douleur ne serait pas en cause : communication, vie sociale et troubles du comportement sont regroupés dans l'ensemble intitulé "retentissement psychosocial" dont ils constituent la totalité des items.
5.2) L'Echelle Comportementale d'évaluation de la douleur pour la Personne Agée (ECPA).
L'échelle ECPA comporte 8 items allant de 0 minimum à 4 maximum, soit 40 possibilités dans sa dernière version. Le score total est donc compris entre 0 (minimum) et 32 (maximum). Cette échelle explore deux dimensions :
- l'observation en dehors des soins,
- l'observation pendant les soins.
Commentaires de l'auteur de ce site : l'ECPA semble mieux adaptée à des patients plus dégradés que ceux évalués à l'aide du DOLOPLUS.
5.3) L'Echelle Sainte Périne (ECS)
Selon Verlhac (Verlhac B. et al, 2001), chaque échelle d'hétéro-évaluation aurait son intérêt respectif : le DOLOPLUS 2 serait adapté la vie en institution, l'ECPA s'adresserait surtout au grabataire (patient confiné au lit et au fauteuil). Quant à elle, l'échelle Sainte Périne est d'un abord facile et conviendrait au dépistage systématique.
5.4) Comparaison entre les échelles françaises ECPA, Doloplus et Sainte Périne (ECS)
5.5) L'échelle Algoplus est de conception plus récente que les grilles précédentes. Elle vise à détecter et à évaluer la douleur aiguë chez la personne âgée souffrant de troubles de la communication verbale. Gageons qu'elle pourra être utilisée aussi pour le suivi de l'efficacité thérapeutique.
Pour l’instant elle relève des indications suivantes, ce qui recouvre la quasi-totalité des situations rencontrées (source des auteurs de la grille : http://www.doloplus.fr/lechelle-algoplus/
· pathologies douloureuses aiguës (ex : fractures, post-op, ischémie, lumbago, zona, rétentions urinaires...)
· accès douloureux transitoires (ex : névralgies faciales, poussées douloureuses sur cancer...)
· douleurs provoquées par les soins ou les actes médicaux diagnostiques.
Algoplus revendique sa validation dans une publication de 2010 (Rat et al, 2010). Ainsi, l'échelle serait validée pour l'évaluation des douleurs aigues chez des personnes âgées avec incapacité de communiquer verbalement. Il convient toutefois de préciser ce que l'on entend par "douleur aiguë". Si l'on se fonde sur cette publication, les douleurs aigues pour lesquelles la validation de l'échelle a été effectuée sont des pathologies telles que des traumatismes dont des fractures, des douleurs abdominales (cholécystite, colique néphrétique), douleurs liées aux plaies et aux escarres, douleurs musculosquelettiques, douleurs thoraciques et pathologies vasculaires périphériques (ischémie). Par ailleurs, les auteurs notent la sensibilité de l'outil à l'accroissement nociceptif lié aux mouvements. Ainsi, l'Algoplus est un outil utile chez des patients dont les mouvements provoquent un pic douloureux. Il s'agit d'une situation très fréquente en pratique quotidienne.
A noter que l’ALGOPLUS ne distingue pas les signes de douleur au repos et au mouvement, contrairement à la CNPI de Feldt (Feldt, 2000).
Citons
encore une grille américaine proche : le PAINAD.
La
difficulté la plus courante est de distinguer d'une part une
mesure au repos et d'autre part une mesure lors des mouvements
et des soins, cette dernière circonstance étant en
pratique la plus fréquente à l’origine de la
provocation ou à l’exacerbation des douleurs sur un mode
aigu. Pour cette raison, nous utilisons depuis peu un outil dérivé
que nous dénommons ALGOPLUS-Albi (format Word
et
format pdf)
afin de le distinguer de l'ALGOPLUS classique. Notre outil compare
les signes observés au repos et au mouvement afin de mieux
discerner les changements induits par les mobilisations et les soins
qui en sont les principaux pourvoyeurs. A noter toutefois que cette
méthode n’est pas validée, contrairement à
l’ALGOPLUS seul qui, après avoir été
validé, revendique sa reconnaissance par l'HAS.
Comme pour l'ECPA, il est intéressant de prendre en compte la cinétique des scores de l'ALGOPLUS-Albi.
Une ressemblance intéressante entre deux outils réalistes car courts et analysant (ou pouvant analyser) les douleurs au repos et lors des mouvements : l'Algoplus
français et la CNPI américaine de Karen Feldt : compararaisonAlgoplus-CNPI.htm
5.6) Echelle d'hétéro-évaluation de Boureau (Vincent H. et al, 2007):
|
Spontanément |
Lors de l'examen |
||||
Absent |
Faible |
Marqué |
Absent |
Faible |
Marqué |
|
0 |
1 |
2 |
0 |
1 |
2 |
|
Pousse des gémissements, des plaintes |
|
|
|
|
|
|
Front plissé, crispations du visage |
|
|
|
|
|
|
Attitudes antalgiques visant à la protection d'une zone en position de repos (assis ou allongé) |
|
|
|
|
|
|
Mouvements précautionneux |
|
|
|
|
|
|
A noter que cette échelle reprend les deux principaux items contenus dans les autres grilles d'hétéroévaluation : les vocalisations non verbales et la mimique.
5.7) D'autres échelles sont disponibles, telles que l'échelle d'Abbey.
5.8) Avantages des outils d'hétéroévaluation
Ils comportent des items plus spécifiques, moins empiriques qu'une observation non guidée.
Ils impliquent et facilitent la discussion et la transmission des données.
Ils permettent la comparaison en équipe des observations d'un même sujet et aident à l'initiation et à l'adaptation de la thérapeutique en utilisant un outil unique chez le même patient.
Ils peuvent être utilisés pour la sensibilisation, la formation et l'information des intervenants : soignants, bénévoles, familles.
5.9) Inconvénients des outils d'hétéroévaluation
L'expérience montre à souhait l'hétérogénéité des cotations de la douleur chez un même patient, en particulier pour les mêmes gestes douloureux. Pour Jean (Jean A. 2002), le biais de l'hétéroévaluation de la douleur chez les patients non communicants réside dans la douleur du soignant lui-même. Pour Bruxelle (Bruxelle, 2009), la cotation dépend aussi de la relation entre le soigné et le soignant. Il en est ainsi d'une comorbidité de dépression qui, par exemple, pourra "faire passer" une EN de 4 à 8.
Attacher trop d'importance à un score peut être réducteur. Selon Keela Herr (Herr K, 2002), un problème relatif aux outils comportementaux d'hétéroévaluation de la douleur comportant un score est la grande variabilité de symptômes suivant les patients. En effet, des patients peuvent manifester un comportement unique qui peut être qualifié de "signature de la douleur". Par exemple, un malade montre des signes de repli sur soi et bouge dans son lit, alors qu'un autre deviendra agressif et fera les cent pas.
Enfin une étude confirmant une observation clinique classique relative à l'hétéroévaluation.
Nous serions inégaux devant la douleur de nos semblables. C'est ce que nous suggère l'étude d’Osborn (Osborn et al, 2009).
Des images ou de courts clips montrant des situations douloureuses sont présentés à des sujets non douloureux. Approximativement un tiers d'entre eux font état d'une authentique expérience douloureuse lors du visionnement de ces scènes. Parmi les « répondeurs », dix d'entre eux sont comparés à dix « non-répondeurs » dans une étude avec IRM encéphalique. On présente alors à tous les sujets des images fixes de situations douloureuses. Les répondeurs activent des aires cérébrales en relation avec les sensations et les émotions éprouvées lors d'une expérience douloureuse. Ceci contraste avec les non-répondeurs qui activent très peu ces zones.
Cette étude est fort instructive quant aux disparités observées lors de l'hétéroévaluation de la douleur chez la personne âgée non verbalisante. La subjectivité de l'observateur est donc un élément majeur de l'appréciation clinique. Ces constats demandent encore à être précisés. Mais il est troublant de constater que des marqueurs d’imagerie encéphalique d’empathie à la douleur peuvent être différents selon un critère aussi trivial que l’attractivité du visage (Kopis et al, 2020). Tremblay retrouve aussi des variations interindividuelles face à des représentations faciales de douleur (Tremblay et al, 2020). Autre exemple, une relation entre empathie à la douleur d’autrui et le fait d’être un consommateur excessif d’alcool a été mise en évidence par Rae (Rae et al, 2020). L’épilepsie essentielle pourrait aussi jouer un rôle (Jiang et al, 2020) négatif sur l’empathie à la douleur.#
Seul un travail en équipe pourra pondérer, si possible, la sensibilité individuelle variable à la douleur de l'Autre. Sans compter avec les relations entre le patient et les soignants, les soignants et la famille du soigné, la famille et le soigné, les diverses équipes soignantes entre elles, les variations intra-individuelles chronologiques, les variations pharmacocinétiques et pharmacodynamiques des antalgiques. Aucune grille d'hétéroévaluation, aussi utile soit-elle ne viendra donner un score indiscutable.
5.10) Une ressemblance troublante :
A propos de l'évaluation de la douleur : aucun signe ne peut en soi être considéré comme pathognomonique de la douleur parce que les signes suspects peuvent survenir isolément dans des situations où la douleur est improbable. Les signes ne sont pas présents tous à la fois, et ceux qui sont présents lors d'un examen peuvent être différents lors de l'examen suivant. C'est pourquoi les signes de douleurs doivent être considérés comme un groupe complexe et doivent être évalués ensemble.
Une vocalisation forte et persistante est une expression occasionnelle mais non fiable de douleur : elle signale plutôt alarme et colère. Un signe de douleur peut être de se blottir dans une posture recroquevillée avec les membres supérieurs sur la poitrine et la tête en avant avec une expression triste ou une grimace et un regard vitreux. Il peut gémir ou crier, éviter ses compagnons, et arrêter de se laver. Il peut aussi attirer l'attention de ses compagnons ; cela peut aller d'un défaut de toilettage à l'attaque. Une douleur abdominale aiguë peut être suspectée par des contorsions faciales, le fait de serrer les dents, l'agitation, ou des secousses accompagnées de grognements et de gémissements. Il refuse habituellement la nourriture et l'eau.
Vous l'aviez deviné : je viens de vous parler de l'évaluation de la douleur chez le singe (Institute for Laboratory Animal Research, 1992).
5.10) Auto et hétéroévaluation de la douleur : une frontière floue ?
Si l’on en croit Postacchini (Postacchini et al, 2013), la seule observation comportementale vidéo par des observateurs, même non spécialistes du rachis, permettrait la reconnaissance d’une fracture-tassement vertébrale dans 89 % des cas.
Les paramètres observés étaient tous non-verbaux :
· Grimace
· Gémissement
· Fermeture ou blocage en occlusion des paupières
· Fermeture ou blocage en occlusion des lèvres
· Nécessité d’une aide pour changer de position
· Extrême difficulté pour effectuer un décubitus ventral
Cette publication montre l’intérêt de l’observation comportementale non-verbale, même en dehors des situations pathologiques entrainant une impossibilité d’expression verbale. On peut supposer que l’expérience ainsi acquise est bénéfique devant le patient douloureux présentant des troubles majeurs de la communication verbale.
5.12) Distinguer la douleur parmi les autres symptômes pénibles
Problème à la fois difficile et passionnant : celui de la différentiation entre la douleur et les autres symptômes pénibles lors de l'inconfort chez la personne âgée démente non verbalisante.
6. Le schéma corporel dénommé de manière triviale : "bonhomme contre la douleur"
Le schéma corporel de face et de dos est destiné à porter les caractéristiques topographiques des douleurs à la connaissance de tous les intervenants. Concrètement, le "bonhomme" devait être disposé dans la chambre du patient, près de son lit.
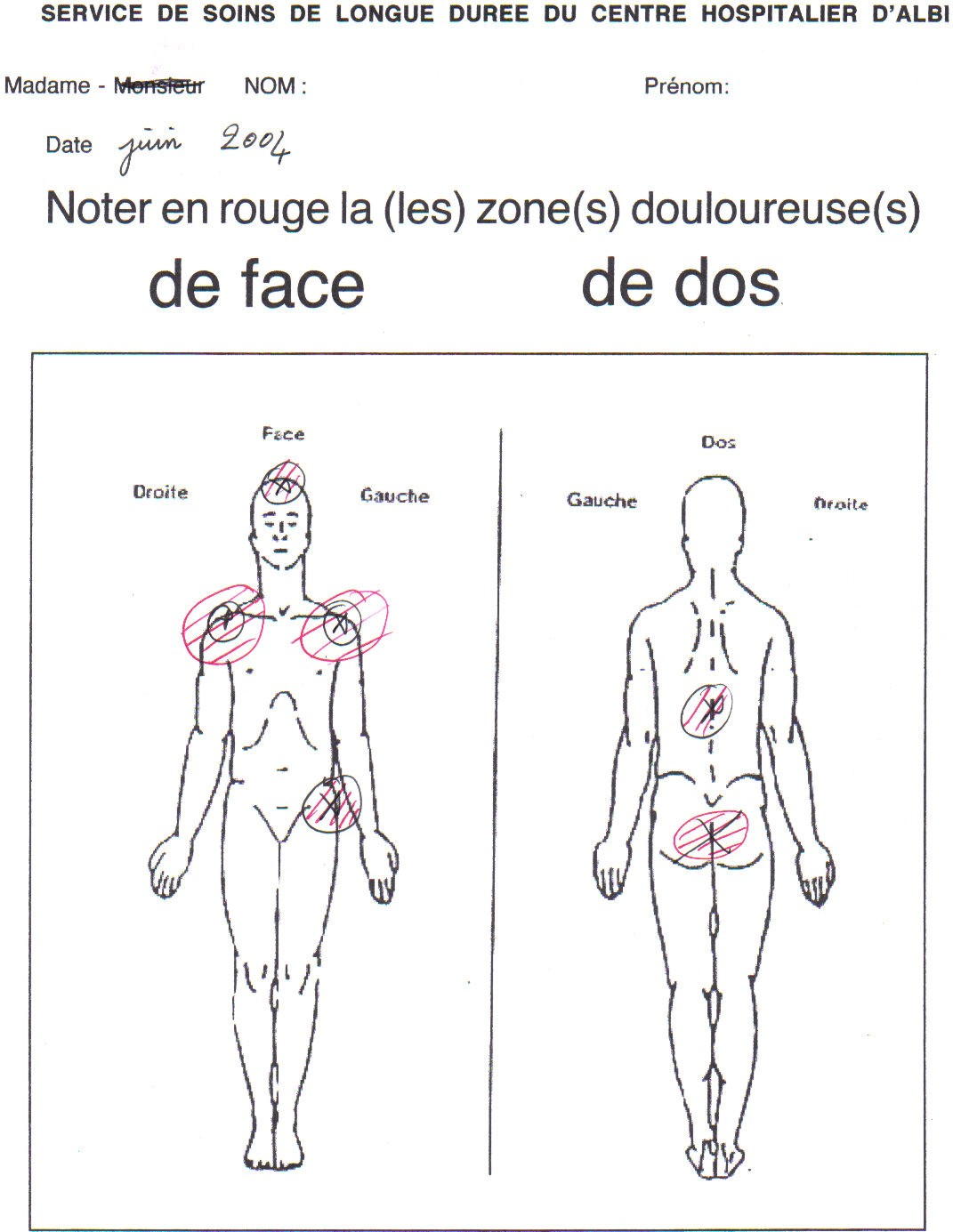
Le "bonhomme" permet de visualiser instantanément la localisation douloureuse chez la personne âgée. Cette représentation schématique est utilisée dans notre service depuis décembre 1998. Il s'agit de l'outil le plus employé car le plus utile.
6.1) Avantages du schéma corporel :
- il permet de visualiser très rapidement, dès l'entrée du résident, les localisations douloureuses afin que les manipulations soient rapidement optimales. Nous ne devrions plus jamais voir chaque nouveau soignant découvrir à son tour la localisation douloureuse, a fortiori dans une localisation connue, par exemple en période postopératoire récente,
- il peut être vu par tous les intervenants, en particulier par les nouveaux soignants,
- il est rare qu'une localisation douloureuse ne demeure pas longtemps sensible à la manipulation,
- il permet de montrer clairement aux intervenants qu'il convient de prendre garde à la douleur de la personne âgée,
- selon Weiner (Weiner et al, 1998), l'intérêt du schéma corporel est de permettre la connaissance des conséquences fonctionnelles de la douleur du résident par l'équipe soignante en soins de longue durée.
- il témoigne auprès du résident et de son entourage de l'intérêt porté au confort du malade.
6.2) Inconvénient du schéma corporel : il peut être jugé désobligeant par la personne âgée qui ne se reconnaît pas dans cette représentation.
7. Comme sa définition l'indique, la douleur est une sensation subjective et émotionnelle.
La notion classique de dissociation anatomo-clinique est une évidence pour tout observateur expérimenté. Ainsi, l'émotion de l'entourage devant une situation bien visible sera-t-elle plus forte que lors d'une affection apparente (fracture, plaie, escarre ...) que lors d'une pathologie invisible (céphalée, lombalgie ...). Ce facteur influence certainement aussi les soignants.
8. L'évaluation par l'efficacité du traitement
L'échelle visuelle analogique, quand elle est utilisable, peut être employée de façon relative à la situation antérieure au traitement. La "douleur maximale" est remplacée par la douleur éprouvée avant l'initiation du traitement. Par ailleurs, la proposition de modification du traitement peut être en soi un indice. La question "pensez-vous que votre traitement doit être augmenté ?" donne une indication intéressante à la fois sur le rapport avantages-inconvénients de la thérapeutique proposée, donc sur l'intensité de la douleur, sur les effets iatrogènes et sur l'observance probable.
9. L'évaluation de l'effet secondaire prédominant du traitement opioïde : la sédation
L'appréciation de la sédation, effet secondaire fréquent des opioïdes, peut être effectuée au moyen d'une échelle de sédation.
Par exemple :
0 : éveillé.
1 : somnolent par intermittence, spontanément éveillable.
2 : somnolent la plupart du temps, facilement éveillable.
3 : très somnolent, éveillable par stimulations tactiles.
Ranovona (Ranovona et al, 2009) fait état de l'échelle de Rudkin. Nous donnons ci-dessous la version de l'AFSSAPS en 2010 (note de bas de page n°3) :
1= patient complètement éveillé,
2= patient somnolent,
3 = patient avec les yeux fermés mais répondant à l’appel,
4 = patient avec les yeux fermés mais répondant à une stimulation tactile légère (traction sur le lobe de l’oreille),
5 = patient avec les yeux fermés et ne répondant pas à une stimulation légère.
10. En soins palliatifs, l'évaluation de la douleur seule ne peut pas rester isolée.
A titre d'exemple, citons l'évaluation proposée par l'équipe d'Edmonton (Bruera et al, 1991). Neuf échelles visuelles analogiques (EVA) sont présentées au patient. Sont ainsi cotés dans cette évaluation les éléments suivants : douleur, activité, nausées, dépression, anxiété, somnolence, appétit, sensation de bien-être et aspect superficiel de la respiration. Si le patient est incapable de coter les EVA, l'évaluation sera réalisée par un soignant ou un parent. L'intérêt de ce "système" est discuté par Rees (Rees et al, 1998) car "le score est inévitablement influencé par l'augmentation du score d'un symptôme isolé". En 1998, Philip (Philip et al, 1998) publie une version légèrement modifiée de cette échelle en la comparant à deux autres outils validés : la Rotterdam Symptom Checklist (RSCL) et le Brief Pain Inventory (BPI). Les auteurs concluent que l'Edmonton Symptom Assessment System (ESAS) modifié est un outil valide, court, susceptible de permettre l'auto-évaluation de la douleur et des autres symptômes chez des patients cancéreux relevant de différentes unités de soins palliatifs. Nous reproduisons ci-dessous l'ESAS modifiée (figure 1, traduction par l'auteur de ce site).
figure 1. Edmonton Symptom Assessment System (ESAS) modifié par Philip et al, 1998. Chaque EVA est notée de 0 à 100 mm, la dernière EVA est cotée séparément et vise à évaluer le soulagement apporté par la thérapeutique.
Cochez, s'il vous plaît, chaque ligne au point qui décrit le mieux votre état à l'heure actuelle :
aucune douleur |
0 % |
_______________________________________________ |
100 % |
pire douleur possible |
pas de faiblesse |
0 % |
_______________________________________________ |
100 % |
pire faiblesse possible |
pas de nausée |
0 % |
_______________________________________________ |
100 % |
pire nausée possible |
pas de dépression |
0 % |
_______________________________________________ |
100 % |
pire dépression possible |
pas d'anxiété |
0 % |
_______________________________________________ |
100 % |
pire anxiété possible |
pas de somnolence |
0 % |
_______________________________________________ |
100 % |
pire somnolence possible |
meilleur appétit possible |
0 % |
_______________________________________________ |
100 % |
pire appétit possible |
meilleure sensation de bien-être |
0 % |
_______________________________________________ |
100 % |
pire sensation de bien-être |
pas de respiration superficielle |
0 % |
_______________________________________________ |
100 % |
pire respiration superficielle |
Dans les dernières 24 heures, quel soulagement vous ont apporté les traitements antidouleur ou les médicaments que vous avez reçus ? Veuillez indiquer le pourcentage de soulagement (0% : aucun soulagement, 100 : soulagement total)
0% ______________________________________________100%
Questionnaire rempli par moi-même (le patient) / l'époux ou épouse ou partenaire/un parent ou ami / un professionnel de soins.
Pour notre part, nous avons extrait de l'outil d'Edmonton les items qui nous paraissaient pertinents car représentant une gêne subjective pour le malade.
L'outil que nous utilisons se trouve à l'adresse suivante : outil dérivé que nous proposons.
En 2004, Mitchell (Mitchell et al. 2004) observe que 71 % des patients présentant une démence avancée meurent dans les six premiers mois après leur admission en maison de retraite médicalisée (nursing home). Leur espérance de vie n'était presque jamais estimée aussi courte auparavant. Les auteurs en concluent que les malades souffrant de cette pathologie ne sont pas considérés comme des personnes en fin de vie. Ceci pourrait compromettre l'approche de leur prise en charge pourtant lourde : escarres (14,7 %), constipation (13,7 %), douleur (11,5 %) et dyspnée (8,2 %).
11. Les douleurs neurogènes (ou neuropathiques) font actuellement l'objet d'une approche spécifique sous l'angle de l'évaluation et du dépistage.
L'échelle DN4 est un progrès important dans le dépistage et l'évaluation de ces douleurs. Possibilité de télécharger cette échelle en format pdf à l'adresse : http://geriatrie-albi.com/DN4.pdf
On pourra aussi se reporter à l'outil LANSS.
La sous-estimation de la fréquence des douleurs neuropathiques ou mixtes devrait nous rendre plus attentifs aux symptômes susceptibles d'évoquer ce type de douleurs. Par exemple, pour Bruce (Bruce et al, 2013), parmi les patientes souffrant d’une douleur chronique post-opératoire au décours d’une chirurgie carcinologique mammaire, un quart d’entre elles éprouvaient une douleur modérée à sévère. 40 % étaient positives à l’échelle DN4 et 25 % à l’échelle S-LANSS.
C. En résumé
Les outils actuels d'évaluation sont sensibles mais ils me paraissent peu spécifiques. Les clefs de la compréhension des douleurs chez les personnes âgées très dégradées sur le plan cognitif reposent essentiellement sur les éléments suivants :
1. la connaissance des caractéristiques des douleurs constatées lorsque patient était capable de les décrire : antécédents rhumatismaux, artériopathiques, chirurgicaux, etc...
2. il convient de garder en mémoire la probabilité de douleur devant une situation nouvelle potentiellement douloureuse telle qu'une fracture, une hémiplégie ou la phase postopératoire.
L'état grabataire apporte aussi son lot de douleurs préoccupantes dues à l'immobilité, surtout présentes lors de la première mobilisation journalière. Selon Thomas (Thomas, 2004), les causes douloureuses facteurs d'agitation les plus fréquentes seraient les suivantes :
- la rétention vésicale complète,
- le fécalome,
- la malposition du malade grabataire dans son lit,
- la fracture méconnue d'un col fémoral,
- l'infarctus du myocarde.
A noter toutefois que l'auteur ne renforce pas cette assertion par une étude spécifique.
L'absence de traitement antalgique peut être considérée comme un indice supplémentaire.
Etudiant 85 patients au décours d'un accident vasculaire cérébral, Aras (Aras et al. 2004) trouve que 54 malades souffraient d'une douleur de l'épaule du côté hémiplégique. Les facteurs favorisants significatifs retrouvés dans cette étude étaient les suivants : une algodystrophie, une plus importante altération motrice fonctionnelle de l'épaule et de la main, une subluxation de la tête humérale, une limitation de la rotation externe et de la flexion de l'épaule ainsi que l'âge. Pour prévenir et amoindrir cette douleur, les auteurs préconisent un positionnement correct de l'épaule, une gamme d'activités de mobilisation et d'éviter l'immobilisation. Commentaire de l'auteur de ce site : pour notre part, nous pratiquons aussi une ou deux infiltrations extraarticulaires loco dolenti à l'aide d'un corticostéroïde local et d'un anesthésique local d'action prolongée : la bupivacaïne. Un obstacle à cette thérapeutique est représenté par la prise d'anticoagulants oraux. Dans tous les cas, l'application locale d'une crème anesthésique mérite d'être tentée (EMLA*).
3. le travail de toute l'équipe
Il inclut l'attention portée aux dires de la famille qui connaît bien son proche et ses modalités réactionnelles, c'est à dire la composante comportementale habituelle de la douleur.
4. l'expérience des observateurs doit être valorisée.
Toutefois, la routine peut aussi amener à la sous-évaluation :
Shugarman (Shugarman et al, 2010) étudie les résultats de l’évaluation de la douleur par une échelle numérique par 94 soignants et par 465 patients en les comparant entre elles pour chaque patient.
Une sous-estimation par les soignants est présente dans 25% des cas, une surestimation dans 7% des cas.
Les facteurs de sous-estimation retrouvés sont les suivants : plus grand nombre d’années d’expérience de l’équipe soignante, anxiété du patient et désordres post-traumatiques. Moins de sous-estimation sont retrouvées si le patient est en bon état de santé.
La surestimation est possible si le protocole d’utilisation de l’échelle numérique est totalement respecté et si les signes vitaux sont relevés dans un environnement faisant diversion.
Commentaires de l’auteur de ce site : la difficulté d’évaluation de la douleur dans le cadre de l’anxiété est bien connue du clinicien, cette dernière pouvant être confondue avec une expression exagérée de la douleur.
5. Au moindre doute, le traitement antalgique sera entrepris et évalué, surtout en l'absence de traitement préalable.
En effet, dans cette situation, les antalgiques de palier 1 et les traitements non médicamenteux, tous généralement bien supportés, seront employés en première intention.
6. Il n'est pas possible de comparer deux patients entre eux lors d'une évaluation.
Seule la comparaison des résultats de deux évaluations successives utilisant le même outil chez le même patient peut fournir une indication valable.
7. L'évaluation doit inclure les diverses dimensions de la douleur : cognitive, affective et comportementale.
Dunn (Dunn et al. 2004) publie une étude concernant 200 personnes âgées vivant hors institution et dont la religion appartient à l’ensemble judéo-chrétien. Il s'intéresse à l'interférence entre la religion et la douleur.
Les auteurs évoquent une échelle à 18 items divisée elle-même en trois sous-échelles que l’on pourrait traduire par les termes suivants : coopératifs avec Dieu, auto-directifs et "de report".
Dans le style «coopératif», la personne et Dieu partagent la responsabilité de la lutte contre la douleur.
Dans le style «auto-directif», la personne prend cette responsabilité à elle seule.
Dans le style «de report», l’individu place la responsabilité de son soulagement dans Dieu seul.
En moyenne, les personnes interrogées utilisent le plus souvent une stratégie de coopération avec Dieu. Elle peut se résumer ainsi : «Quand je m’inquiète à propos de ma douleur, je coopère avec Dieu pour lui donner un sens». De même, ces personnes douloureuses partagent avec Dieu le choix du traitement.
Puis vient la stratégie de report. Ici, les personnes ne s’interrogent pas sur le sens de leur douleur : ils donnent à Dieu le soin de le définir.
Enfin, le moins souvent, une stratégie de responsabilité personnelle était utilisée, de type «auto-directif».
Commentaires personnels de l’auteur de ce site :
Ce dernier résultat est somme toute compréhensible dans une approche cognitive religieuse. La recherche et l’utilisation des stratégies religieuses de lutte contre la douleur constituent une approche souvent oubliée dans la lutte contre la douleur chez la personne âgée.
La bibliographie relative à cette page est incluse dans l'ordre alphabétique des auteurs à l'adresse suivante : bibliographie.
Revenir au sommaire de la page relative à la douleur chez la personne âgée